研究活動について
組織球症に伴う中枢神経変性症の診療ガイド3病態
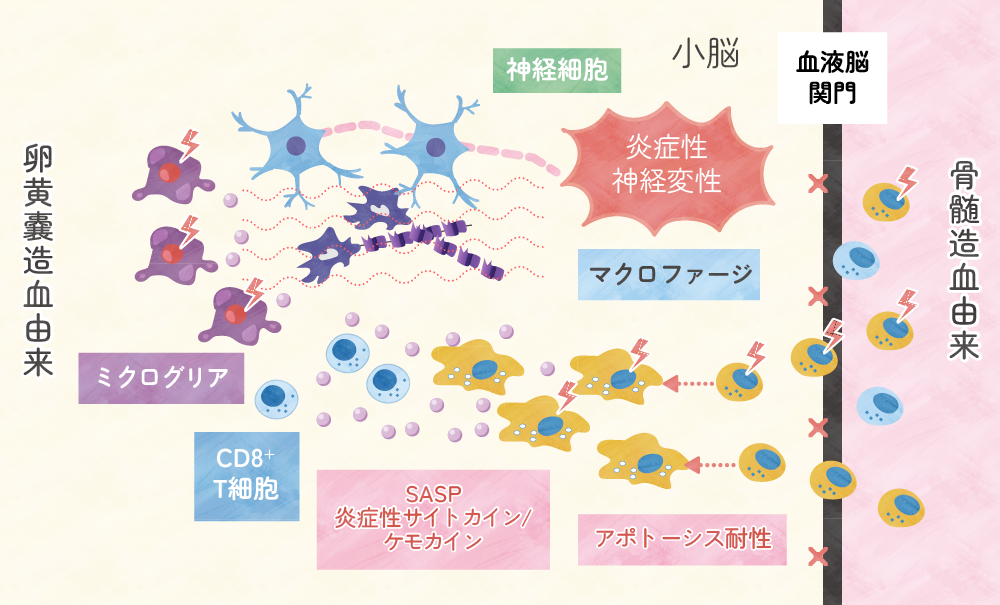
組織球症に伴う中枢神経変性症(Histiocytosis-ND)患者の脳病変では、CD8陽性T細胞とマクロファージの浸潤による著明な炎症像があり、ミクログリアの活性化、神経細胞喪失、軸索腫大、グリオーシスがみられる1-5)。これらのことから、Histiocytosis-NDは、慢性炎症による神経細胞および軸索の損傷、すなわち炎症性神経変性と考えられる(図1)。
LCH-ND患者は90%以上がBRAFV600E変異陽性例であり、BRAFV600E陽性のLCH患者は、陰性患者に比べ10倍以上もLCH-NDを続発する率が高い6)。Erdheim-Chester病(ECD)に生ずる中枢神経変性症(ECD-ND)例も、ほとんどがBRAFV600E変異陽性である7)。
LCH-ND患者では、BRAFV600E変異アレルが髄液中で検出されることは稀(10%)であるが、LCHの腫瘍性病変が消失している時期であっても、末梢血単核球中には高率にBRAFV600E変異アレルが検出される(LCH治療開始前:ND患者59% vs. 非ND患者15%、腫瘍性病変消失時期:ND患者22% vs. 非ND患者0%)4)。また、髄液中で炎症性サイトカイン/ケモカインであるosteopontin(OPN)が上昇しており、脳病変では血管周囲にOPNを高発現したBRAFV600E変異陽性のマクロファージの浸潤を認める4)。
造血幹細胞にBRAFV600E変異を発現させたトランスジェニックマウスは、高リスクLCH類似の病像を呈し、末梢血中に発がん性遺伝子誘発性細胞老化の特性、すなわちTNF-αに代表される炎症性サイトカインを過剰に分泌するsenescence-associated secretory phenotype(SASP)およびアポトーシス耐性を示すBRAFV600E変異陽性の単球系細胞が検出される8)。この細胞が血液脳関門を破壊して脳実質内に侵入し、そこで炎症性マクロファージに分化して、脳幹や小脳に集簇し、炎症性神経変性を引き起こすと考えられる8) (図1)。このとき、脳内に浸潤している炎症性マクロファージの大半はBRAFV600E変異陰性であり、BRAFV600E変異陽性の割合は10%弱である。おそらくこれは、BRAFV600E変異陰性の単球系細胞もSASPによって老化細胞となり9)、脳内に浸潤しやすくなって脳病変を増悪させている可能性が考えられる。
BRAFV600E変異を導入した人工多能性幹細胞(iPSC)から分化した造血幹細胞は、CD14⁺前駆細胞からミクログリア様細胞へと分化する。このミクログリア様細胞はiPSC由来神経細胞を傷害する10)。
一方、骨髄造血ではなく、卵黄嚢造血由来の組織常在性マクロファージであるミクログリアに遺伝子変異が入り、神経変性を引き起こすという説もある11)。卵黄嚢赤血球骨髄前駆細胞にBRAFV600E変異を導入したトランスジェニックマウスは、腫瘍性の全身性病変は呈さないが、Histiocytosis-NDと同様の活性化ミクログリアの蓄積と重篤な遅発性神経変性疾患を引き起こす。
直近の報告5)では、LCHおよびECD患者ともに、明らかな神経症状を認めない例においても、橋や小脳、海馬にBRAFV600E変異陽性のミクログリア様細胞の活性化を伴う炎症、神経細胞の消失、軸索腫大がみられる。このミクログリア様細胞は、骨髄由来の例もあるが、骨髄由来が証明できない(卵黄嚢造血由来の常在性マクロファージ由来が疑われる)例もある(図1)。この両者で臨床像に違いはない。
これらのことから、LCH-NDは「ミクログリアのクローン性増殖による進行性の中枢神経障害」として理解されつつある。BRAFV600E変異などMAPK経路のドライバー変異を有するミクログリア様細胞が、脳内で慢性的な炎症反応を引き起こし、ニューロンの脱落およびグリアの異常増殖を誘導することが明らかとなった。また、ミクログリア変異クローンの起源には、末梢血由来と脳内常在由来の2種類が存在する可能性が示唆されるが、その組織球の起源についてはさらなる研究が必要である。
図1.BRAFV600E変異陽性単球系細胞による炎症性神経変性
参考文献
- Grois N, Prayer D, Prosch H, et al. Neuropathology of CNS disease in Langerhans cell histiocytosis. Brain 2005; 128: 829-838.
- Chiapparini L, Cavalli G, Langella T, et al. Adult leukoencephalopathies with prominent infratentorial involvement can be caused by Erdheim-Chester disease. J Neurol. 2018; 265: 273-284.
- Riso V, Nicoletti TF, Rossi S, et al. Neurological Erdheim-Chester Disease Manifesting with Subacute or Progressive Cerebellar Ataxia: Novel Case Series and Review of the Literature. Brain Sci. 2022; 13: 26.
- McClain KL, Picarsic J, Chakraborty R, et al. CNS Langerhans cell histiocytosis: Common hematopoietic origin for LCH-associated neurodegeneration and mass lesions. Cancer 2018; 124: 2607-2620.
- Vicario R, Fragkogianni S, Pokrovskii M, et al. Role of clonal inflammatory microglia in histiocytosis-associated neurodegeneration. Neuron. 2025; 113: 1065-1081.e13.
- Heritier S, Barkaoui MA, Miron J, et al. Incidence and risk factors for clinical neurodegenerative Langerhans cell histiocytosis: a longitudinal cohort study. Br J Haematol 2018; 183: 608-617.
- Chiapparini L, Cavalli G, Langella T, et al. Adult leukoencephalopathies with prominent infratentorial involvement can be caused by Erdheim-Chester disease. J Neurol. 2018; 265: 273-284.
- Wilk CM, Cathomas F, Török O, et al. Circulating senescent myeloid cells infiltrate the brain and cause neurodegeneration in histiocytic disorders. Immunity. 2023; 56: 2790–2802.
- Biavasco R, Lettera E, Giannetti K, et al. Oncogene-induced senescence in hematopoietic progenitors features myeloid restricted hematopoiesis, chronic inflammation and histiocytosis. Nat Commun. 2021; 12: 4559.
- Abagnale R, Schwentner R, Soussia-Weiss PB, et al. BRAF V600E induces key features of LCH in iPSCs with cell type-specific phenotypes and drug responses. Blood. 2025; 145: 850–865.
- Mass E, Jacome-Galarza CE, Blank T, et al. A somatic mutation in erythro-myeloid progenitors causes neurodegenerative disease. Nature. 2017; 549: 389-393.
